Задания С 2 (2013г)
Реакции, подтверждающие взаимосвязь различных классов неорганических веществ
Оксид меди(II) нагрели в токе угарного газа. Полученное вещество сожгли в атмосфере хлора. Продукт реакции растворили в воде. Полученный раствор разделили на две части. К одной части добавили раствор иодида калия, ко второй – раствор нитрата серебра. И в том и в другом случае наблюдали образование осадка. Напишите уравнения четырех описанных реакций.
Нитрат меди прокалили, образовавшееся твердое вещество растворили в разбавленной серной кислоте. Раствор полученной соли подвергли электролизу. Выделившееся на катоде вещество растворили в концентрированной азотной кислоте. Растворение протекало с выделением бурого газа. Напишите уравнения четырех описанных реакций.
Железо сожгли в атмосфере хлора. Полученное вещество обработали избытком раствора гидроксида натрия. Образовался бурый осадок, который отфильтровали и прокалили. Остаток после прокаливания растворили в иодоводородной кислоте. Напишите уравнения четырех описанных реакций.
Порошок металлического алюминия смешали с твердым иодом и добавили несколько капель воды. К полученной соли добавили раствор гидроксида натрия до выпадения осадка. Образовавшийся осадок растворили в соляной кислоте. При последующем добавлении раствора карбоната натрия вновь наблюдали выпадение осадка. Напишите уравнения четырех описанных реакций.
В результате неполного сгорания угля получили газ, в токе которого нагрели оксид железа(III). Полученное вещество растворили в горячей концентрированной серной кислоте. Образовавшийся раствор соли подвергли электролизу. Напишите уравнения четырех описанных реакций.
Некоторое количество сульфида цинка разделили на две части. Одну из них обработали азотной кислотой, а другую подвергли обжигу на воздухе. При взаимодействии выделившихся газов образовалось простое вещество. Это вещество нагрели с концентрированной азотной кислотой, причем выделился бурый газ. Напишите уравнения четырех описанных реакций.
Серу сплавили с железом. Продукт реакции растворили в воде. Выделившийся при этом газ сожгли в избытке кислорода. Продукты горения поглотили водным раствором сульфата железа(III). Напишите уравнения четырех описанных реакций.
Железо сожгли в хлоре. Полученную соль добавили к раствору карбоната натрия, при этом выпал бурый осадок. Этот осадок отфильтровали и прокалили. Полученное вещество растворили в иодоводородной кислоте. Напишите уравнения четырех описанных реакций.
Раствор иодида калия обработали избытком хлорной воды, при этом наблюдали сначала образование осадка, а затем – его полное растворение. Образовавшуюся при этом иодосодержащую кислоту выделили из раствора, высушили и осторожно нагрели. Полученный оксид прореагировал с угарным газом. Запишите уравнения описанных реакций.
Порошок сульфида хрома(III) растворили в серной кислоте. При этом выделился газ и образовался окрашенный раствор. К полученному раствору добавили избыток раствора аммиака, а газ пропустили через нитрата свинца. Полученный при этом черный осадок побелел после обработки его пероксидом водорода. Запишите уравнения описанных реакций.
Порошок алюминия нагрели с порошком серы, полученное вещество обработали водой. Выделившийся при этом осадок обработали избытком концентрированного раствора гидроксида калия до его полного растворения. К полученному раствору добавили раствор хлорида алюминия и вновь наблюдали образование белого осадка. Запишите уравнения описанных реакций.
Нитрат калия нагрели с порошкообразным свинцом до прекращения реакции. Смесь продуктов обработали водой, а затем полученный раствор профильтровали. Фильтрат подкислили серной кислотой и обработали иодидом калия. Выделившееся простое вещество нагрели с концентрированной азотной кислотой. В атмосфере образовавшегося при этом бурого газа сожгли красный фосфор. Запишите уравнения описанных реакций.
Медь растворили в разбавленной азотной кислоте. К полученному раствору добавили избыток раствора аммиака, наблюдая сначала образование осадка, а затем – его полное растворение с образованием темно-синего раствора. Полученный раствор обработали серной кислотой до появления характерной голубой окраски солей меди. Запишите уравнения описанных реакций.
Магний растворили в разбавленной азотной кислоте, причем выделение газа не наблюдалось. Полученный раствор обработали избытком раствора гидроксида калия при нагревании. Выделившийся при этом газ сожгли в кислороде. Запишите уравнения описанных реакций.
Смесь порошков нитрита калия и хлорида аммония растворили в воде и раствор осторожно нагрели. Выделившийся газ прореагировал с магнием. Продукт реакции внесли в избыток раствора соляной кислоты, при этом выделение газа не наблюдалось. Полученную магниевую соль в растворе обработали карбонатом натрия. Запишите уравнения описанных реакций.
Оксид алюминия сплавили с гидроксидом натрия. Продукт реакции внесли в раствор хлорида аммония. Выделившийся газ с резким запахом поглощен серной кислотой. Образовавшуюся при этом среднюю соль прокалили. Запишите уравнения описанных реакций.
Хлор прореагировал с горячим раствором гидроксида калия. При охлаждении раствора выпали кристаллы бертолетовой соли. Полученные кристаллы внесли в раствор соляной кислоты. Образовавшееся простое вещество прореагировало с металлическим железом. Продукт реакции нагрели с новой навеской железа. Запишите уравнения описанных реакций.
Медь растворили в концентрированной азотной кислоте. К полученному раствору добавили избыток раствора аммиака, наблюдая сначала образование осадка, а затем – его полное растворение. Полученный раствор обработали избытком соляной кислоты. Запишите уравнения описанных реакций.
Железо растворили в горячей концентрированной серной кислоте. Полученную соль обработали избытком раствора гидроксида натрия. Выпавший бурый осадок отфильтровали и прокалили. Полученное вещество сплавили с железом. Напишите уравнения четырёх описанных реакций.
|
1)CuO + CO=Cu+CO 2 2) Cu+Cl 2 =CuCl 2 3) 2CuCl 2 +2KI=2CuCl↓ +I 2 +2KCl 4) CuCl 2 +2AgNO 3 =2AgCl↓+Cu(NO 3) 2 |
1)Cu(NO 3) 2 2CuO+4NO 2 +O 2 2) CuO+2H 2 SO 4 =CuSO 4 +SO 2 +2H 2 O 3)CuSO 4 +H 2 O=Cu↓+H 2 SO 4 +O 2 (элект 4)Cu+4HNO 3 =Cu(NO 3) 2 +2NO 2 +2H 2 O |
1) 2Fe + 3Cl 2 = 2FeCl 3 2)FeCl 3 + 3NaOH = Fe(OH) 3 ↓+3NaCl 4)Fe 2 O 3 + 6HI = 2FeI 2 + I 2 + 3H 2 O |
|
1) 2Al+3I 2 = 2AlI 3 2) AlI 3 +3NaOH= Al(OH) 3 +3NaI 3)Al(OH) 3 +3HCl= AlCl 3 + 3H 2 O 4)2AlCl 3 +3Na 2 CO 3 +3H 2 O=2Al(OH) 3 +3CO 2 +6NaCl |
2) Fe 2 O 3 +CO=Fe+CO 2 3)2Fe+6H 2 SO 4 =Fe 2 (SO 4) 3 +3SO 2 +6H 2 O 4)Fe 2 (SO 4) 3 +4H 2 O=2Fe+H 2 +3H 2 SO 4 +O 2 (электролиз) |
1) ZnS+2HNO 3 =Zn(NO 3) 2 +H 2 S 2)2ZnS +3O 2 =2ZnO +2SO 2 3)2H 2 S+SO 2 =3S↓+2H 2 O 4)S+6HNO 3 =H 2 SO 4 +6NO 2 +2H 2 O |
|
2) FeS + 2H 2 O=Fe(OH) 2 +H 2 S 3)2H 2 S+3O 2 2SO 2 +2H 2 O 4)Fe 2 (SO 4) 3 +SO 2 +2H 2 O=2FeSO 4 + 2H 2 SO 4 |
1) 2Fe + 3Cl 2 = 2FeCl 3 2)2FeCl 3 +3Na 2 CO 3 =2Fe(OH) 3 +6NaCl+3CO 2 3) 2Fe(OH) 3 Fe 2 O 3 + 3H 2 O 4) Fe 2 O 3 + 6HI = 2FeI 2 + I 2 + 3H 2 O |
1)2KI+Cl 2 =2KCl+I 2 2)I 2 +5Cl 2 +6H 2 O=10HCl+2HIO 3 3)2HIO 3 I 2 O 5 + H 2 O 4) I 2 O 5 +5CO = I 2 +5CO 2 |
|
1)Cr 2 S 3 +3H 2 SO 4 =Cr 2 (SO 4) 3 +3H 2 S 2)Cr 2 (SO 4) 4 +6NH 3 +6H 2 O=2Cr(OH) 3 ↓+3(NH 4) 2 SO 4 3)H 2 S+Pb(NO 3) 2 =PbS↓+2HNO 3 4)PbS+4H 2 O 2 =PbSO 4 +4H 2 O |
1)2Al+3S Al 2 S 3 2)Al 2 S 3 +6H 2 O=2Al(OH) 3 ↓+3H 2 S 3)Al(OH) 3 +KOH=K 4)3K+AlCl 3 =3KCl+Al(OH) 3 ↓ |
1)KNO 3 +Pb KNO 2 +PbO 2)2KNO 2 +2H 2 SO 4 +2KI=2K 2 SO 4 + 2NO+I 2 +2H 2 O 3)I 2 +10HNO 3 2HIO 3 +10NO 2 +4H 2 O 4)10NO 2 +P=2P 2 O 5 +10NO |
|
1)3Cu+8HNO 3 =3Cu(NO 3) 2 +2NO+4H 2 O 4)(OH) 2 +3H 2 SO 4 = CuSO 4 +2(NH 4) 2 SO 4 + 2H 2 O |
1)4Mg+10HNO 3 = 4Mg(NO 3) 2 +NH 4 NO 3 + 3H 2 O 2) Mg(NO 3) 2 +2KOH=Mg(OH) 2 ↓+2KNO 3 3)NH 4 NO 3 +KOHKNO 3 +NH 3 +H 2 O 4)4NH 3 +3O 2 =2N 2 +6H 2 O |
1)KNO 2 +NH 4 Cl KCl+N 2 +2H 2 O 2)3Mg+N 2 =Mg 3 N 2 3)Mg 3 N 2 +8HCl=3MgCl 2 +2NH 4 Cl 4)2MgCl 2 +2Na 2 CO 3 +H 2 O= (MgOH) 2 CO 3 ↓+ CO 2 +4NaCl |
|
1)Al 2 O 3 +2NaOH 2NaAlO 2 +H 2 O 2)NaAlO 2 +NH 4 Cl+H 2 O=NaCl+ Al(OH) 3 ↓+NH 3 3)2NH 3 +H 2 SO 4 =(NH 4) 2 SO 4 4)(NH 4) 2 SO 4 NH 3 +NH 4 HSO 4 |
1)3Cl 2 +6KOH6KCl+KClO 3 +3H 2 O 2)6HCl+KClO 3 =KCl+3Cl 2 +3H 2 O 3)2Fe+3Cl 2 =2FeCl 3 4)2FeCl 3 +Fe3FeCl 2 |
1)3Cu+4HNO 3 =3Cu(NO 3) 2 +2NO 2 +4H 2 O 2)Cu(NO 3) 2 +2NH 3 H 2 O=Cu(OH) 2 + 2NH 4 NO 3 3)Cu(OH) 2 +4NH 3 H 2 O =(OH) 2 + 4H 2 O 4)(OH) 2 +6HCl= CuCl 2 +4NH 4 Cl + 2H 2 O |
|
19 Документ C 2 Реакции , подтверждающие взаимосвязь различных классов неорганических веществ Даны водные растворы... Напишите уравнения четырех возможных реакций . Даны вещества : бромоводородная кислота, ... в осадок в ходе реакции вещество желтого цвета сожгли на... Сводный отчет председателей предметных комиссий Астраханской области по учебным предметам государственной итоговой аттестации по образовательным программам среднего общего образованияОтчет4 21.9 40.6 С2 Реакции , подтверждающие взаимосвязь различных классов неорганических веществ 54.1 23.9 9.9 7.7 4.3 С3 Реакции , подтверждающие взаимосвязь органических соединений 56.8 10 ... Календарно-тематическое планирование занятиЙ по подготовке к егэ по химии в 2013−2014 учебном году ПредметКалендарно-тематическое планирование25) 27.03.2014 Реакции , подтверждающие взаимосвязь различных классов неорганических веществ . Решение упражнений С-2 ... простых веществ . Химические свойства сложных веществ . Взаимосвязь различных классов неорганических веществ . Реакции ионного обмена... Календарно-тематический план занятий по подготовке к егэ по химии выпускников школ г. Барнаула и Алтайского края в 2015 г. Номер занятияКалендарно-тематический план... (на примере соединений алюминия и цинка). Взаимосвязь неорганических веществ . Реакции , подтверждающие взаимосвязь различных классов неорганических веществ (37 (С2)). 28 февраля 2015 ... |
Соляная кислота.
В химических реакциях соляная кислота проявляет все свойства сильных кислот: взаимодействует с металлами , стоящими в ряду напряжений левее водорода, с оксидами (основными, амфотерными), основаниями, амфотерными гидроксидами и солями:
2HCl + Fe = FeCl 2 + H 2
2HCl + CaO = CaCl 2 + H 2 O
6HCl + Al 2 O 3 = 2AlCl 3 + 3H 2 O
HCl + NaOH = NaCl + H 2 O
2HCl + Cu(OH) 2 = CuCl 2 + 2H 2 O
2HCl + Zn(OH) 2 = ZnCl 2 + 2H 2 O
HCl + NaHCO 3 = NaCl + CO 2 + H 2 O
HCl + AgNO 3 = AgCl↓ + HNO 3 (качественная реакция на галогенид-ионы)
6HCl (конц.) + 2HNO 3(конц.) = 3Cl 2 + 2NO + 4H 2 O
HClO 2 – хлористая
HClO 3 – хлорноватая
HClO 4 – хлорная
HClO HClO 2 HClO 3 HClO 4
усиление кислотных свойств
2HClO 2HCl + O 2
HClO + 2HI = HCl + I 2 + H 2 O
HClO + H 2 O 2 = HCl + H 2 O + O 2
Соли.
Соли соляной кислоты – хлориды.
NaCl + AgNO 3 = AgCl↓ + NaNO 3 (качественная реакция на галогенид-ионы)
AgCl + 2(NH 3 ∙ H 2 O) = Cl + 2H 2 O
2AgCl 2Ag + Cl 2
Соли кислородсодержащих кислот.
Ca(ClO) 2 + H 2 SO 4 = CaSO 4 + 2HCl + O 2
Ca(ClO) 2 + CO 2 + H 2 O = CaCO 3 + 2HClO
Ca(ClO) 2 + Na 2 CO 3 = CaCO 3 + 2NaClO
Ca(ClO) 2 CaCl 2 + O 2
4KClO 3 3KClO 4 + KCl
2KClO 3 2KCl + 3O 2
2KClO 3 + 3S 2KCl + 3SO 2
5KClO 3 + 6P 5KCl + 3P 2 O 5
KClO 4 2O 2 + KCl
3KClO 4 + 8Al = 3KCl + 4Al 2 O 3
Бром. Соединения брома.
Br 2 + H 2 = 2HBr
Br 2 + 2Na = 2NaBr
Br 2 + Mg = MgBr 2
Br 2 + Cu = CuBr 2
3Br 2 + 2Fe = 2FeBr 3
Br 2 + 2NaOH (разб) = NaBr + NaBrO + H 2 O
3Br 2 + 6NaOH (конц.) = 5NaBr + NaBrO 3 + 3H 2 O
Br 2 + 2NaI = 2NaBr + I 2
3Br 2 + 3Na 2 CO 3 = 5NaBr + NaBrO 3 + 3CO 2
3Br 2 + S + 4H 2 O = 6HBr + H 2 SO 4
Br 2 + H 2 S = S + 2HBr
Br 2 + SO 2 + 2H 2 O = 2HBr + H 2 SO 4
4Br 2 + Na 2 S 2 O 3 + 10NaOH = 2Na 2 SO 4 + 8NaBr + 5H 2 O
14HBr + K 2 Cr 2 O 7 = 2KBr + 2CrBr 3 + 3Br 2 + 7H 2 O
4HBr + MnO 2 = MnBr 2 + Br 2 + 2H 2 O
2HBr + H 2 O 2 = Br 2 + 2H 2 O
2KBr + 2H 2 SO 4 (конц.) = 4K 2 SO 4 + 4Br 2 + SO 2 + 2H 2 O
2KBrO 3 3O 2 + 2KBr
2KBrO 4 O 2 + 2KBrO 3 (до 275°С)
KBrO 4 2O 2 + KBr (выше 390°С)
Йод. Соединения йода.
3I 2 + 3P = 2PI 3
I 2 + H 2 = 2HI
I 2 + 2Na = 2NaI
I 2 + Mg = MgI 2
I 2 + Cu = CuI 2
3I 2 + 2Al = 2AlI 3
3I 2 + 6NaOH (гор.) = 5NaI + NaIO 3 + 3H 2 O
I 2 + 2NaOH (разб) = NaI + NaIO + H 2 O
3I 2 + 10HNO 3 (разб) = 6HIO 3 + 10NO + 2H 2 O
I 2 + 10HNO 3 (конц.) = 2HIO 3 + 10NO 2 + 4H 2 O
I 2 + 5NaClO + 2NaOH = 5NaCl + 2NaIO 3 + H 2 O
I 2 + 5Cl 2 + 6H 2 O = 10HCl + 2HIO 3
I 2 + Na 2 SO 3 + 2NaOH = 2NaI + Na 2 SO 4 + H 2 O
2HI + Fe 2 (SO 4) 3 = 2FeSO 4 + I 2 + H 2 SO 4
2HI + NO 2 = I 2 + NO + H 2 O
2HI + S = I 2 + H 2 S
8KI + 5H 2 SO 4 (конц.) = 4K 2 SO 4 + 4I 2 + H 2 S + 4H 2 O или
KI + 3H 2 O + 3Cl 2 = HIO 3 + KCl + 5HCl
10KI + 8H 2 SO 4 + 2KMnO 4 = 5I 2 + 2MnSO 4 + 6K 2 SO 4 + 8H 2 O
6KI + 7H 2 SO 4 + K 2 Cr 2 O 7 = Cr 2 (SO 4) 3 + 3I 2 + 4K 2 SO 4 + 7H 2 O
2KI + H 2 SO 4 + H 2 O 2 = I 2 + K 2 SO 4 + 2H 2 O
2KI + Fe 2 (SO 4) 3 = I 2 + 2FeSO 4 + K 2 SO 4
2KI + 2CuSO 4 + K 2 SO 3 + H 2 O = 2CuI + 2K 2 SO 4 + H 2 SO 4
2HIO 3 I 2 O 5 + H 2 O
2HIO 3 + 10HCl = I 2 + 5Cl 2 + 6H 2 O
2HIO 3 + 5Na 2 SO 3 = 5Na 2 SO 4 + I 2 + H 2 O
2HIO 3 + 5H 2 SO 4 + 10FeSO 4 = Fe 2 (SO 4) 3 + I 2 + 6H 2 O
I 2 O 5 + 5CO I 2 + 5CO 2
2KIO 3 3O 2 + 2KI
2KIO 3 + 12HCl (конц.) = I 2 + 5Cl 2 + 2KCl + 6H 2 O
KIO 3 + 3H 2 SO 4 + 5KI = 3I 2 + 3K 2 SO 4 + 3H 2 O
KIO 3 + 3H 2 O 2 = KI + 3O 2 + 3H 2 O
2KIO 4 O 2 + 2KIO 3
5KIO 4 + 3H 2 O + 2MnSO 4 = 2HMnO 4 + 5KIO 3 + 2H 2 SO 4
Галогены.
1. Вещество, полученное на аноде при электролизе расплава иодида натрия с инертными электродами, выделили и ввели во взаимодействие с сероводородом. Газообразный продукт последней реакции растворили в воде и к полученному раствору добавили хлорное железо. Образовавшийся осадок отфильтровали и обработали горячим раствором гидроксида натрия. Напишите уравнения описанных реакций.
2. Вещество, полученное на аноде при электролизе раствора иодида натрия с инертными электродами, ввели в реакцию с калием. Продукт реакции нагрели с концентрированной серной кислотой и выделившийся газ пропустили через горячий раствор хромата калия. Напишите уравнения описанных реакций.
3. Хлорная вода имеет запах хлора. При подщелачивании запах исчезает, а при добавлении соляной кислоты – становится более сильным, чем был ранее. Напишите уравнения описанных реакций.
4. Бесцветные газы выделяются при выдерживании концентрированной кислоты , как с хлоридом натрия, так и с иодидом натрия. При пропускании этих газов через водный раствор аммиака образуются соли. Напишите уравнения описанных реакций.
5. При термическом разложении соли А в присутствии диоксида марганца образовались бинарная соль Б и газ, поддерживающий горение и входящий в состав воздуха, при нагревании этой соли без катализатора образуются соль Б и соль кислородсодержащей кислоты. При взаимодействии соли А с соляной кислотой выделяется жёлто-зелёный газ (простое вещество) и образуется соль Б. соль Б окрашивает пламя в фиолетовый цвет, при её взаимодействии с раствором нитрата серебра выпадает осадок белого цвета. Напишите уравнения описанных реакций.
6) При добавлении раствора кислоты А к диоксиду марганца происходит выделение ядовитого газа жёлто-зелёного газа. Пропустив выделившийся газ через горячий раствор едкого кали, получают вещество, которое используется при изготовлении спичек и некоторых других зажигательных составов. При термическом разложении последнего в присутствии диоксида марганца образуется соль, из которой при взаимодействии с концентрированной серной кислотой можно получить исходную кислоту А, и бесцветный газ, входящий в состав атмосферного воздуха. Напишите уравнения описанных реакций.
7) Йод нагрели с избытком фосфора , и продукт реакции обработали небольшим количеством воды. Газообразный продукт реакции полностью нейтрализовали раствором едкого натра и добавили в полученный раствор нитрат серебра. Напишите уравнения описанных реакций.
8) Газ, выделившийся при нагревании твердой поваренной соли с концентрированной серной кислотой, пропустили через раствор перманганата калия. Газообразный продукт реакции поглотили холодным раствором едкого натра. После добавления в полученный раствор йодоводородной кислоты появляется резкий запах и раствор приобретает тёмную окраску. Напишите уравнения описанных реакций.
9) Через раствор бромида натрия пропустили газ, выделяющийся при взаимодействии соляной кислоты с перманганатом калия. После окончания реакции раствор выпарили, остаток растворили в воде и подвергли электролизу с графитовыми электродами. Газообразные продукты реакции смешали друг с другом и осветили. В результате произошел взрыв. Напишите уравнения описанных реакций.
10) К пиролюзиту осторожно прибавили раствор соляной кислоты, и выделившийся газ пропустили в химический стакан, наполненный холодным раствором едкого кали. После окончания реакции стакан накрыли картонкой и оставили , при этом стакан освещали солнечные лучи; через некоторое время в стакан внесли тлеющую лучинку, которая ярко вспыхнула. Напишите уравнения описанных реакций.
11) Вещество, выделяющееся на катоде и аноде при электролизе раствора йодида натрия с графитовыми электродами, реагируют друг с другом. Продукт реакции взаимодействуют с концентрированной серной кислотой с выделением газа, который пропустили через раствор гидроксида калия. Напишите уравнения описанных реакций.
12) К оксиду свинца (IV) при нагревании добавили концентрированную соляную кислоту. Выделяющийся газ пропустили через нагретый раствор едкого кали. Раствор охладили, соль кислородсодержащей кислоты отфильтровали и высушили. При нагревании полученной соли с соляной кислотой выделяется ядовитый газ, а при нагревании её в присутствии диоксида марганца – газ, входящий в состав атмосферы. Напишите уравнения описанных реакций.
13) Йод обработали концентрированной азотной кислотой при нагревании. Продукт реакции осторожно нагрели. Образовавшийся при оксид вступил в реакцию с угарным газом. Выделившееся простое вещество растворили в теплом растворе гидроксида калия. Напишите уравнения описанных реакций.
14) Раствор иодида калия обработали избытком хлорной воды , при этом сначала наблюдали образование осадка, а затем – его полное растворение. Образовавшуюся при этом йодсодержащую кислоту выделили из раствора, высушили и осторожно нагрели. полученный оксид прореагировал с угарным газом. Напишите уравнения описанных реакций.
15) Йод обработали хлорноватой кислотой. Продукт реакции осторожно нагрели. продукт реакции осторожно нагрели. Образующийся оксид реагирует с угарным газом с образованием двух веществ – простого и сложного. Простое вещество растворяется в теплом щелочном растворе сульфита натрия. Напишите уравнения описанных реакций.
16) Перманганат калия обработали избытком раствора соляной кислоты, образовался раствор и выделился газ. Раствор разделили на две части: к первой добавили гидроксид калия, а ко второй – нитрат серебра. Выделившийся газ прореагировал газ прореагировал с гидроксидом калия при охлаждении. Напишите уравнения описанных реакций.
17) Расплав хлорида натрия подвергли электролизу. Газ, выделившийся на аноде, прореагировал с водородом с образованием нового газообразного вещества с характерным запахом. Его растворили в воде и обработали расчетным количеством перманганата калия, при этом образовался газ желто-зеленого цвета. Это вещество вступает при охлаждении с гидроксидом натрия. Напишите уравнения описанных реакций.
18) Перманганат калия обработали концентрированной соляной кислотой. Выделившийся при этом газ собрали , а к реакционной массе по каплям прибавили раствор гидроксида калия до прекращения выделения осадка. Собранный газ пропустили через горячий раствор гидроксида калия, при этом образовалась смесь двух солей. Раствор выпарили, твердый остаток прокалили в присутствии катализатора, после чего в твердом остатке осталась одна соль. Напишите уравнения описанных реакций.
Галогены.
1) 2NaI ![]() 2Na + I 2
2Na + I 2
на катоде на аноде
I 2 + H 2 S = 2HI + S↓
2HI + 2FeCl 3 = I 2 + 2FeCl 2 + 2HCl
I 2 + 6NaOH (гор.) = NaIO 3 + 5NaI + 3H 2 O
2) 2NaI + 2H 2 O ![]() 2H 2 + 2NaOH + I 2
2H 2 + 2NaOH + I 2
На катоде на аноде
8KI + 8H 2 SO 4(конц.) = 4I 2 ↓ + H 2 S + 4K 2 SO 4 + 4H 2 O или
8KI + 9H 2 SO 4 (конц.) = 4I 2 ↓ + H 2 S + 8KHSO 4 + 4H 2 O
3H 2 S + 2K 2 CrO 4 + 2H 2 O = 2Cr(OH) 3 + 3S + 4KOH
3) Cl 2 + H 2 O ↔ HCl + HClO
HCl + NaOH = NaCl + H 2 O
HClO + NaOH = NaClO + H 2 O
NaClO + 2HCl = NaCl + Cl 2 + H 2 O
4) H 2 SO 4(конц.) + NaCl (тверд.) = NaHSO 4 + HCl
9H 2 SO 4(конц.) + 8NaI (тверд.) = 8NaHSO 4 + 4I 2 ↓ + H 2 S + 4H 2 O
NH 4 OH + HCl = NH 4 Cl + H 2 O
NH 4 OH + H 2 S = NH 4 HS + H 2 O
5) 2KClO 3 2KCl + 3O 2
4KClO 3 KCl + 3KClO 4
KClO 3 + 6HCl = KCl + 3Cl 2 + 3H 2 O
KCl + AgNO 3 = AgCl↓ + KNO 3
6) 4HCl + MnO 2 = MnCl 2 + Cl 2 + 2H 2 O
3Cl 2 + 6KOH (гор.) = 5KCl + KClO 3 + 3H 2 O
2KClO 3 2KCl + 3O 2
H 2 SO 4(конц.) + NaCl (тверд.) = NaHSO 4 + HCl
7) 3I 2 + 3P = 2PI 3
PI 3 + 3H 2 O = H 3 PO 3 + 3HI
HI + NaOH = NaI + H 2 O
NaI + AgNO 3 = AgI↓ + NaNO 3
8) H 2 SO 4(конц.) + NaCl (тверд.) = NaHSO 4 + HCl
16HCl + 2KMnO 4 = 5Cl 2 + 2KCl + 2MnCl 2 + 8H 2 O
Cl 2 + 2NaOH (хол.) = NaCl + NaClO + H 2 O
NaClO + 2HI = NaCl + I 2 + H 2 O
9) 16HCl + 2KMnO 4 = 5Cl 2 + 2KCl + 2MnCl 2 + 8H 2 O
Пособие-репетитор по химии
ЗАНЯТИЕ 10
10-й класс
(первый год обучения)
Продолжение. Начало см. в № 22/2005; 1, 2, 3, 5, 6, 8, 9, 11/2006
Окислительно-восстановительные реакции
План
1. Окислительно-восстановительные реакции (ОВР), степень окисления.
2. Процесс окисления, важнейшие восстановители.
3. Процесс восстановления, важнейшие окислители.
4. Окислительно-восстановительная двойственность.
5. Основные типы ОВР (межмолекулярные, внутримолекулярные, диспропорционирование).
6. Значение ОВР.
7. Методы составления уравнений ОВР (электронный и электронно-ионный баланс).
Все химические реакции по признаку изменения степеней окисления участвующих в них атомов можно разделить на два типа: ОВР (протекающие с изменением степеней окисления) и не ОВР.
Степень окисления – условный заряд атома в молекуле, рассчитанный, исходя из предположения, что в молекуле существуют только ионные связи.
П р а в и л а д л я о п р е д е л е н и я с т е п е н е й о к и с л е н и я
Степень окисления атомов простых веществ равна нулю.
Сумма степеней окисления атомов в сложном веществе (в молекуле) равна нулю.
Степень окисления атомов щелочных металлов +1.
Степень окисления атомов щелочно-земельных металлов +2.
Степень окисления атомов бора, алюминия +3.
Степень окисления атомов водорода +1 (в гидридах щелочных и щелочно-земельных металлов –1).
Степень окисления атомов кислорода –2 (в пероксидах –1).
Любая ОВР представляет собой совокупность процессов отдачи и присоединения электронов.
Процесс отдачи электронов называют окислением. Частицы (атомы, молекулы или ионы), отдающие электроны, называют восстановителями. В результате окисления степень окисления восстановителя увеличивается. Восстановителями могут быть частицы в низшей или промежуточной степенях окисления. Важнейшими восстановителями являются: все металлы в виде простых веществ, особенно активные; C, CO, NH 3 , PH 3 , CH 4 , SiH 4 , H 2 S и сульфиды, галогеноводороды и галогениды металлов, гидриды металлов, нитриды и фосфиды металлов.
Процесс присоединения электронов называют восстановлением. Частицы, принимающие электроны, называют окислителями. В результате восстановления степень окисления окислителя уменьшается. Окислителями могут быть частицы в высшей или промежуточной степенях окисления. Важнейшие окислители: простые вещества-неметаллы, обладающие высокой электроотрицательностью (F 2 , Cl 2 , O 2), перманганат калия, хроматы и дихроматы, азотная кислота и нитраты, концентрированная серная кислота, хлорная кислота и перхлораты.
Различают три типа окислительно-восстановительных реакций.
Межмолекулярные ОВР – окислитель и восстановитель входят в состав различных веществ, например:

Внутримолекулярные ОВР – окислитель и восстановитель входят в состав одного вещества. Это могут быть разные элементы, например:

или один химический элемент в разных степенях окисления, например:

Диспропорционирование (самоокисление-самовосстановление) – окислителем и восстановителем является один и тот же элемент, находящийся в промежуточной степени окисления, например:

ОВР имеют огромное значение, поскольку большинство реакций, протекающих в природе, относятся к этому типу (процесс фотосинтеза, горение). Кроме того, ОВР активно используются человеком в его практической деятельности (восстановление металлов, синтез аммиака):

Для составления уравнений ОВР можно использовать метод электронного баланса (электронных схем) или метод электронно-ионного баланса.
Метод электронного баланса:
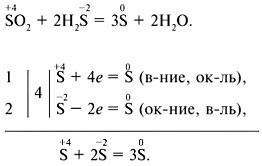
Метод электронно-ионного баланса:

Тест по теме «Окислительно-восстановительные реакции»
1. Дихромат калия обработали сернистым газом в сернокислом растворе, а затем водным раствором сульфида калия. Конечным веществом Х является:
а) хромат калия; б) оксид хрома(III);
в) гидроксид хрома(III); г) сульфид хрома(III).
2. Какой продукт реакции между перманганатом калия и бромоводородной кислотой может реагировать с сероводородом?
а) Бром; б) бромид марганца(II);
в) диоксид марганца; г) гидроксид калия.
3. При окислении йодида железа(II) азотной кислотой образуются йод и монооксид азота. Чему равно отношение коэффициента при окислителе к коэффициенту при восстановителе в уравнении этой реакции?
а) 4: 1; б) 8: 3; в) 1: 1; г) 2: 3.
4. Степень окисления атома углерода в гидрокарбонат-ионе равна:
а) +2; б) –2; в) +4; г) +5.
5. Перманганат калия в нейтральной среде восстанавливается до:
а) марганца; б) оксида марганца(II);
в) оксида марганца(IV); г) манганата калия.
6. Сумма коэффициентов в уравнении реакции диоксида марганца с концентрированной соляной кислотой равна:
а) 14; б) 10; в) 6; г) 9.
7. Из перечисленных соединений только окислительную способность проявляют:
а) серная кислота; б) сернистая кислота;
в) сероводородная кислота; г) сульфат калия.
8. Из перечисленных соединений окислительно-восстановительную двойственность проявляют:
а) пероксид водорода; б) пероксид натрия;
в) сульфит натрия; г) сульфид натрия.
9. Из перечисленных ниже типов реакций окислительно-восстановительными являются реакции:
а) нейтрализации; б) восстановления;
в) диспропорционирования; г) обмена.
10. Степень окисления атома углерода численно не совпадает с его валентностью в веществе:
а) тетрахлорид углерода; б) этан;
в) карбид кальция; г) угарный газ.
Ключ к тесту
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| в | а | а | в | в | г | а, г | а, б, в | б, в | б, в |
Упражнения по
окислительно-восстановительным реакциям
(электронный и электронно-ионный баланс)
Задание 1. Составить уравнения ОВР с помощью метода электронного баланса, определить тип ОВР.
1. Цинк + дихромат калия + серная кислота = сульфат цинка + сульфат хрома(III) + сульфат калия + вода.
Электронный баланс:

2. Сульфат олова(II) + перманганат калия + серная кислота = сульфат олова(IV) + сульфат марганца + сульфат калия + вода.
3. Йодид натрия + перманганат калия + гидроксид калия = йод + манганат калия + гидроксид натрия.
4. Сера + хлорат калия + вода = хлор + сульфат калия + серная кислота.
5. Йодид калия + перманганат калия + серная кислота = сульфат марганца(II) + йод + сульфат калия + вода.
6. Сульфат железа(II) + дихромат калия + серная кислота = сульфат железа(III) + сульфат хрома(III) + сульфат калия + вода.
7. Нитрат аммония = оксид азота(I) + вода.
8. Фосфор + азотная кислота = фосфорная кислота + оксид азота(IV) + вода.
9. Азотистая кислота = азотная кислота + оксид азота(II) + вода.
10. Хлорат калия + соляная кислота = хлор + хлорид калия + вода.
11. Дихромат аммония = азот + оксид хрома(III) + вода.
12. Гидроксид калия + хлор = хлорид калия + хлорат калия + вода.
13. Оксид серы(IV) + бром + вода = серная кислота + бромоводородная кислота.
14. Оксид серы(IV) + сероводород = сера + вода.
15. Сульфит натрия = сульфид натрия + сульфат натрия.
16. Перманганат калия + соляная кислота = хлорид марганца(II) + хлор + хлорид калия + вода.
17. Ацетилен + кислород = углекислый газ + вода.
18. Нитрит калия + перманганат калия + серная кислота = нитрат калия + сульфат марганца(II) + сульфат калия + вода.
19. Кремний + гидроксид калия + вода = силикат калия + водород.
20. Платина + азотная кислота + соляная кислота = хлорид платины(IV) + оксид азота(II) + вода.
21. Сульфид мышьяка + азотная кислота = мышьяковая кислота + сернистый газ + диоксид азота + вода.
22. Перманганат калия = манганат калия + оксид марганца(IV) + кислород.
23.
Сульфид меди(I) + кислород + карбонат
кальция = оксид меди(II) + сульфит кальция +
+ углекислый газ.
24.
Хлорид железа(II) + перманганат калия +
соляная кислота = хлорид железа(III) + хлор +
+ хлорид марганца(II) + хлорид калия + вода.
25. Сульфит железа(II) + перманганат калия + серная кислота = сульфат железа(III) + сульфат марганца(II) + сульфат калия + вода.
Ответы на упражнения задания 1


При использовании метода полуреакций (электронно-ионный баланс) следует иметь в виду, что в водных растворах связывание избыточного кислорода и присоединение кислорода восстановителем происходит по-разному в кислой, нейтральной и щелочной средах. В кислых растворах избыток кислорода связывается протонами с образованием молекул воды, а в нейтральных и щелочных – молекулами воды с образованием гидроксид-ионов. Присоединение кислорода восстановителем осуществляется в кислой и нейтральной средах за счет молекул воды с образованием ионов водорода, а в щелочной среде – за счет гидроксид-ионов с образованием молекул воды.
Нейтральная среда:
Щелочная среда:
окислитель + Н 2 О = … + ОН – ,
восстановитель + ОН – = … + Н 2 О.
Кислая среда:
окислитель + Н + = … + Н 2 О,
восстановитель + Н 2 О = … + Н + .
Задание 2. С помощью метода электронно-ионного баланса составить уравнения ОВР, протекающих в определенной среде.
1. Сульфит натрия + перманганат калия + вода = ...................... .
2. Гидроксид железа(II) + кислород + вода = ............................... .
3. Бромид натрия + перманганат калия + вода = ......................... .
4. Сероводород + бром + вода = серная кислота + ...................... .
5. Нитрат серебра(I) + фосфин + вода = серебро + фосфорная кислота + .............................. .
В щ е л о ч н о й с р е д е
1. Сульфит натрия + перманганат калия + гидроксид калия = ...................... .
2. Бромид калия + хлор + гидроксид калия = бромат калия + ...................... .
3. Сульфат марганца(II) + хлорат калия + гидроксид калия = манганат калия + ...................... .
4. Хлорид хрома(III) + бром + гидроксид калия = хромат калия + ...................... .
5. Оксид марганца(IV) + хлорат калия + гидроксид калия = манганат калия + ...................... .
В к и с л о й с р е д е
1. Сульфит натрия + перманганат калия + серная кислота = ...................... .
2. Нитрит калия + йодид калия + серная кислота = оксид азота (II) + ...................... .
3. Перманганат калия + оксид азота(II) + серная кислота = оксид азота(IV) + ...................... .
4. Йодид калия + бромат калия + соляная кислота = ...................... .
5. Нитрат марганца(II) + оксид свинца(IV) + азотная кислота = марганцовая кислота +
+ ...................... .
Ответы на упражнения задания 2
В н е й т р а л ь н о й с р е д е

Задание 3. С помощью метода электронно-ионного баланса составить уравнения ОВР.
1. Гидроксид марганца(II) + хлор + гидроксид калия = оксид марганца(IV) + ...................... .
Электронно-ионный баланс:

2. Оксид марганца(IV) + кислород + гидроксид калия = манганат калия +...................... .
3. Сульфат железа(II) + бром + серная кислота = ...................... .
4. Йодид калия + сульфат железа(III) = ....................... .
5. Бромоводород + перманганат калия = ............................. .
6. Хлороводород + оксид хрома(VI) = хлорид хрома(III) + ...................... .
7. Аммиак + бром = ...................... .
8. Оксид меди(I) + азотная кислота = оксид азота(II) + ...................... .
9. Сульфид калия + манганат калия + вода = сера + ...................... .
10. Оксид азота(IV) + перманганат калия + вода = ...................... .
11. Йодид калия + дихромат калия + серная кислота = ............................. .
12. Сульфид свинца(II) + пероксид водорода = ............................ .
13. Хлорноватистая кислота + пероксид водорода = соляная кислота + ...................... .
14. Йодид калия + пероксид водорода = .............................. .
15. Перманганат калия + пероксид водорода = оксид марганца(IV) + ................................... .
16. Йодид калия + нитрит калия + уксусная кислота = оксид азота(II) + ............................... .
17. Перманганат калия + нитрит калия + серная кислота = ................................. .
18. Сернистая кислота + хлор + вода = серная кислота + ...................... .
19. Сернистая кислота + сероводород = сера + ............................. .
1) Нитрат меди прокалили, полученный твёрдый осадок растворили в серной кислоте. Через раствор пропустили сероводород, полученный чёрный осадок подвергли обжигу, а твёрдый остаток растворили при нагревании в концентрированной азотной кислоте.
2) Фосфат кальция сплавили с углём и песком, затем полученное простое вещество сожгли в избытке кислорода, продукт сжигания растворили в избытке едкого натра. К полученному раствору прилили раствор хлорида бария. Полученный осадок обработали избытком фосфорной кислоты.
| Показать | |
|---|---|
Ca 3 (PO 4) 2 → P → P 2 O 5 →Na 3 PO 4 → Ba 3 (PO 4) 2 → BaHPO 4 или Ba(H 2 PO 4) 2 Ca 3 (PO 4) 2 + 5C + 3SiO 2 → 3CaSiO 3 + 2P + 5CO |
|
3) Медь растворили в концентрированной азотной кислоте, полученный газ смешали с кислородом и растворили в воде. В полученном растворе растворили оксид цинка, затем к раствору прибавили большой избыток раствора гидроксида натрия.
4) На сухой хлорид натрия подействовали концентрированной серной кислотой при слабом нагревании, образующийся газ пропустили в раствор гидроксида бария. К полученному раствору прилили раствор сульфата калия. Полученный осадок сплавили с углем. Полученное вещество обработали соляной кислотой.
5) Навеску сульфида алюминия обработали соляной кислотой. При этом выделился газ и образовался бесцветный раствор. К полученному раствору добавили раствор аммиака, а газ пропустили через раствор нитрата свинца. Полученный при этом осадок обработали раствором пероксида водорода.
| Показать | |
|---|---|
Al(OH) 3 ←AlCl 3 ←Al 2 S 3 → H 2 S → PbS →PbSO 4 Al 2 S 3 + 6HCl → 3H 2 S + 2AlCl 3 |
|
6) Порошок алюминия смешали с порошком серы, смесь нагрели, полученное вещество обработали водой, при этом выделился газ и образовался осадок, к которому добавили избыток раствора гидроксида калия до полного растворения. Этот раствор выпарили и прокалили. К полученному твёрдому веществу добавили избыток раствора соляной кислоты.
7) Раствор иодида калия обработали раствором хлора. Полученный осадок обработали раствором сульфита натрия. К полученному раствору прибавили сначала раствор хлорида бария, а после отделения осадка - добавили раствор нитрата серебра.
8) Серо-зелёный порошок оксида хрома (III) сплавили с избытком щёлочи, полученное вещество растворили в воде, при этом получился тёмно-зелёный раствор. К полученному щелочному раствору прибавили пероксид водорода. Получился раствор желтого цвета, который при добавлении серной кислоты приобретает оранжевый цвет. При пропускании сероводорода через полученный подкисленный оранжевый раствор он мутнеет и вновь становится зелёным.
| Показать | |
|---|---|
Cr 2 O 3 → KCrO 2 → K →K 2 CrO 4 →K 2 Cr 2 O 7 → Cr 2 (SO 4) 3 Cr 2 O 3 + 2KOH → 2KCrO 2 + H 2 O |
|
9) Алюминий растворили в концентрированном растворе гидроксида калия. Через полученный раствор пропускали углекислый газ до прекращения выделения осадка. Осадок отфильтровали и прокалили. Полученный твердый остаток сплавили с карбонатом натрия.
10) Кремний растворили в концентрированном растворе гидроксида калия. К полученному раствору добавили избыток соляной кислоты. Помутневший раствор нагрели. Выделившийся осадок отфильтровали и прокалили с карбонатом кальция. Напишите уравнения описанных реакций.
11) Оксид меди(II) нагрели в токе угарного газа. Полученное вещество сожгли в атмосфере хлора. Продукт реакции растворили в воде. Полученный раствор разделили на две части. К одной части добавили раствор иодида калия, ко второй – раствор нитрата серебра. И в том и в другом случае наблюдали образование осадка. Напишите уравнения четырех описанных реакций.
12) Нитрат меди прокалили, образовавшееся твердое вещество растворили в разбавленной серной кислоте. Раствор полученной соли подвергли электролизу. Выделившееся на катоде вещество растворили в концентрированной азотной кислоте. Растворение протекало с выделением бурого газа. Напишите уравнения четырех описанных реакций.
13) Железо сожгли в атмосфере хлора. Полученное вещество обработали избытком раствора гидроксида натрия. Образовался бурый осадок, который отфильтровали и прокалили. Остаток после прокаливания растворили в иодоводородной кислоте. Напишите уравнения четырех описанных реакций.
14) Порошок металлического алюминия смешали с твердым иодом и добавили несколько капель воды. К полученной соли добавили раствор гидроксида натрия до выпадения осадка. Образовавшийся осадок растворили в соляной кислоте. При последующем добавлении раствора карбоната натрия вновь наблюдали выпадение осадка. Напишите уравнения четырех описанных реакций.
15) В результате неполного сгорания угля получили газ, в токе которого нагрели оксид железа(III). Полученное вещество растворили в горячей концентрированной серной кислоте. Образовавшийся раствор соли подвергли электролизу. Напишите уравнения четырех описанных реакций.
16) Некоторое количество сульфида цинка разделили на две части. Одну из них обработали азотной кислотой, а другую подвергли обжигу на воздухе. При взаимодействии выделившихся газов образовалось простое вещество. Это вещество нагрели с концентрированной азотной кислотой, причем выделился бурый газ. Напишите уравнения четырех описанных реакций.
17) Хлорат калия нагрели в присутствии катализатора, при этом выделился бесцветный газ. Сжиганием железа в атмосфере этого газа была получена железная окалина. Её растворили в избытке соляной кислоты. К полученному при этом раствору добавили раствор, содержащий дихромат натрия и соляную кислоту.
| Показать | |
|---|---|
1) 2КClО 3 → 2КСl + 3О 2 2) ЗFe + 2O 2 → Fе 3 O 4 3) Fе 3 O 4 + 8НСІ → FeCl 2 + 2FeCl 3 + 4Н 2 О 4) 6 FeCl 2 + Na 2 Cr 2 O 7 + 14 НСІ → 6 FeCl 3 + 2 CrCl 3 + 2NaCl + 7Н 2 О 18) Железо сожгли в хлоре. Полученную соль добавили к раствору карбоната натрия, при этом выпал бурый осадок. Этот осадок отфильтровали и прокалили. Полученное вещество растворили в иодоводородной кислоте. Напишите уравнения четырех описанных реакций. 1) 2Fe + 3Cl 2 → 2FeCl 3 2)2FeCl 3 +3Na 2 CO 3 →2Fe(OH) 3 +6NaCl+3CO 2 3) 2Fe(OH) 3 Fe 2 O 3 + 3H 2 O 4) Fe 2 O 3 + 6HI → 2FeI 2 + I 2 + 3H 2 O |
|
19) Раствор иодида калия обработали избытком хлорной воды, при этом наблюдали сначала образование осадка, а затем – его полное растворение. Образовавшуюся при этом иодосодержащую кислоту выделили из раствора, высушили и осторожно нагрели. Полученный оксид прореагировал с угарным газом. Запишите уравнения описанных реакций.
20) Порошок сульфида хрома(III) растворили в серной кислоте. При этом выделился газ и образовался окрашенный раствор. К полученному раствору добавили избыток раствора аммиака, а газ пропустили через нитрата свинца. Полученный при этом черный осадок побелел после обработки его пероксидом водорода. Запишите уравнения описанных реакций.
21) Порошок алюминия нагрели с порошком серы, полученное вещество обработали водой. Выделившийся при этом осадок обработали избытком концентрированного раствора гидроксида калия до его полного растворения. К полученному раствору добавили раствор хлорида алюминия и вновь наблюдали образование белого осадка. Запишите уравнения описанных реакций.
22) Нитрат калия нагрели с порошкообразным свинцом до прекращения реакции. Смесь продуктов обработали водой, а затем полученный раствор профильтровали. Фильтрат подкислили серной кислотой и обработали иодидом калия. Выделившееся простое вещество нагрели с концентрированной азотной кислотой. В атмосфере образовавшегося при этом бурого газа сожгли красный фосфор. Запишите уравнения описанных реакций.
23) Медь растворили в разбавленной азотной кислоте. К полученному раствору добавили избыток раствора аммиака, наблюдая сначала образование осадка, а затем – его полное растворение с образованием темно-синего раствора. Полученный раствор обработали серной кислотой до появления характерной голубой окраски солей меди. Запишите уравнения описанных реакций.
| Показать | |
|---|---|
1)3Cu+8HNO 3 →3Cu(NO 3) 2 +2NO+4H 2 O 2)Cu(NO 3) 2 +2NH 3 H 2 O→Cu(OH) 2 + 2NH 4 NO 3 3)Cu(OH) 2 +4NH 3 H 2 O →(OH) 2 + 4H 2 O 4)(OH) 2 +3H 2 SO 4 → CuSO 4 +2(NH 4) 2 SO 4 + 2H 2 O |
|
24) Магний растворили в разбавленной азотной кислоте, причем выделение газа не наблюдалось. Полученный раствор обработали избытком раствора гидроксида калия при нагревании. Выделившийся при этом газ сожгли в кислороде. Запишите уравнения описанных реакций.
25) Смесь порошков нитрита калия и хлорида аммония растворили в воде и раствор осторожно нагрели. Выделившийся газ прореагировал с магнием. Продукт реакции внесли в избыток раствора соляной кислоты, при этом выделение газа не наблюдалось. Полученную магниевую соль в растворе обработали карбонатом натрия. Запишите уравнения описанных реакций.
26) Оксид алюминия сплавили с гидроксидом натрия. Продукт реакции внесли в раствор хлорида аммония. Выделившийся газ с резким запахом поглощен серной кислотой. Образовавшуюся при этом среднюю соль прокалили. Запишите уравнения описанных реакций.
27) Хлор прореагировал с горячим раствором гидроксида калия. При охлаждении раствора выпали кристаллы бертолетовой соли. Полученные кристаллы внесли в раствор соляной кислоты. Образовавшееся простое вещество прореагировало с металлическим железом. Продукт реакции нагрели с новой навеской железа. Запишите уравнения описанных реакций.
28) Медь растворили в концентрированной азотной кислоте. К полученному раствору добавили избыток раствора аммиака, наблюдая сначала образование осадка, а затем – его полное растворение. Полученный раствор обработали избытком соляной кислоты. Запишите уравнения описанных реакций.
29) Железо растворили в горячей концентрированной серной кислоте. Полученную соль обработали избытком раствора гидроксида натрия. Выпавший бурый осадок отфильтровали и прокалили. Полученное вещество сплавили с железом. Напишите уравнения четырёх описанных реакций.
30) В результате неполного сгорания угля получили газ, в токе которого нагрели оксид железа(ІІІ). Полученное вещество растворили в горячей концентрированной серной кислоте. Образовавшийся раствор соли обработали избытком раствора сульфида калия.
31) Некоторое количество сульфида цинка разделили на две части. Одну из них обработали соляной кислотой, а другую подвергли обжигу на воздухе. При взаимодействии выделившихся газов образовалось простое вещество. Это вещество нагрели с концентрированной азотной кислотой, причём выделился бурый газ.
32) Серу сплавили с железом. Продукт реакции обработали соляной кислотой. Выделившийся при этом газ сожгли в избытке кислорода. Продукты горения поглотили водным раствором сульфата железа(ІІІ).
В 2012 году предложена новая форма задания С2 — в виде текста, описывающего последовательность экспериментальных действий, которые нужно превратить в уравнения реакций.
Трудность такого задания состоит в том, что школьники очень плохо представляют себе экспериментальную, не бумажную химию, не всегда понимают используемые термины и протекающие процессы. Попробуем разобраться.
Очень часто понятия, которые химику кажутся совершенно ясными, абитуриентами воспринимаются неправильно, не так, как предполагалось. В словаре приведены примеры неправильного понимания.
Словарь непонятных терминов.
- Навеска — это просто некоторая порция вещества определенной массы (её взвесили на весах ). Она не имеет никакого отношения к навесу над крыльцом.
- Прокалить — нагреть вещество до высокой температуры и греть до окончания химических реакций. Это не «смешивание с калием» и не «прокалывание гвоздём».
- «Взорвали смесь газов» — это значит, что вещества прореагировали со взрывом. Обычно для этого используют электрическую искру. Колба или сосуд при этом не взрываются !
- Отфильтровать — отделить осадок от раствора.
- Профильтровать — пропустить раствор через фильтр, чтобы отделить осадок.
- Фильтрат — это профильтрованный раствор .
- Растворение вещества — это переход вещества в раствор. Оно может происходить без химических реакций (например, при растворении в воде поваренной соли NaCl получается раствор поваренной же соли NaCl, а не щелочь и кислота отдельно), либо в процессе растворения вещество реагирует с водой и образует раствор другого вещества (при растворении оксида бария получится раствор гидроксида бария). Растворять можно вещества не только в воде, но и в кислотах, в щелочах и т.д.
- Выпаривание — это удаление из раствора воды и летучих веществ без разложения содержащихся в растворе твёрдых веществ.
- Упаривание — это просто уменьшение массы воды в растворе с помощью кипячения.
- Сплавление — это совместное нагревание двух или более твёрдых веществ до температуры, когда начинается их плавление и взаимодействие. С плаванием по реке ничего общего не имеет.
- Осадок и остаток.
Очень часто путают эти термины. Хотя это совершенно разные понятия.
«Реакция протекает с выделением осадка» — это означает, что одно из веществ, получающихся в реакции, малорастворимо. Такие вещества выпадают на дно реакционного сосуда (пробирки или колбы).
«Остаток» — это вещество, которое осталось , не истратилось полностью или вообще не прореагировало. Например, если смесь нескольких металлов обработали кислотой, а один из металлов не прореагировал — его могут назвать остатком . - Насыщенный
раствор — это раствор, в котором при данной температуре концентрация вещества максимально возможная и больше уже не растворяется.
Ненасыщенный раствор — это раствор, концентрация вещества в котором не является максимально возможной, в таком растворе можно дополнительно растворить ещё какое-то количество данного вещества, до тех пор, пока он не станет насыщенным.
Разбавленный и «очень» разбавленный раствор — это весьма условные понятия, скорее качественные, чем количественные. Подразумевается, что концентрация вещества невелика.
Для кислот и щелочей также используют термин «концентрированный» раствор. Это тоже характеристика условная. Например, концентрированная соляная кислота имеет концентрацию всего около 40%. А концентрированная серная — это безводная, 100%-ная кислота.
Для того, чтобы решать такие задачи, надо чётко знать свойства большинства металлов, неметаллов и их соединений: оксидов, гидроксидов, солей. Необходимо повторить свойства азотной и серной кислот, перманганата и дихромата калия, окислительно-восстановительные свойства различных соединений, электролиз растворов и расплавов различных веществ, реакции разложения соединений разных классов, амфотерность, гидролиз солей и других соединений, взаимный гидролиз двух солей.
Кроме того, необходимо иметь представление о цвете и агрегатном состоянии большинства изучаемых веществ — металлов, неметаллов, оксидов, солей.
Именно поэтому мы разбираем этот вид заданий в самом конце изучения общей и неорганической химии.
Рассмотрим несколько примеров подобных заданий.
Пример 1: Продукт взаимодействия лития с азотом обработали водой. Полученный газ пропустили через раствор серной кислоты до прекращения химических реакций. Полученный раствор обработали хлоридом бария. Раствор профильтровали, а фильтрат смешали с раствором нитрита натрия и нагрели.
Решение:
- Литий реагирует с азотом при комнатной температуре, образуя твёрдый нитрид лития:
6Li + N 2 = 2Li 3 N - При взаимодействии нитридов с водой образуется аммиак:
Li 3 N + 3H 2 O = 3LiOH + NH 3 - Аммиак реагирует с кислотами, образуя средние и кислые соли. Слова в тексте «до прекращения химических реакций» означают, что образуется средняя соль, ведь первоначально получившаяся кислая соль далее будет взаимодействовать с аммиаком и в итоге в растворе будет сульфат аммония:
2NH 3 + H 2 SO 4 = (NH 4) 2 SO 4 - Обменная реакция между сульфатом аммония и хлоридом бария протекает с образованием осадка сульфата бария:
(NH 4) 2 SO 4 + BaCl 2 = BaSO 4 + 2NH 4 Cl - После удаления осадка фильтрат содержит хлорид аммония, при взаимодействии которого с раствором нитрита натрия выделяется азот, причём эта реакция идёт уже при 85 градусах:
Пример 2: Навеску алюминия растворили в разбавленной азотной кислоте, при этом выделялось газообразное простое вещество. К полученному раствору добавили карбонат натрия до полного прекращения выделения газа. Выпавший осадок отфильтровали и прокалили , фильтрат упарили , полученный твёрдый остаток сплавили с хлоридом аммония. Выделившийся газ смешали с аммиаком и нагрели полученную смесь.
Решение:
- Алюминий окисляется азотной кислотой, образуя нитрат алюминия. А вот продукт восстановления азота может быть разным, в зависимости от концентрации кислоты. Но надо помнить, что при взаимодействии азотной кислоты с металлами не выделяется водород
! Поэтому простым веществом может быть только азот:
10Al + 36HNO 3 = 10Al(NO 3) 3 + 3N 2 + 18H 2 O - В растворе остался нитрат натрия. При его сплавлении с солями аммония идёт окислительно-восстановительная реакция и выделяется оксид азота (I) (такой же процесс происходит при прокаливании нитрата аммония):
NaNO 3 + NH 4 Cl = N 2 O + 2H 2 O + NaCl - Оксид азота (I) — является активным окислителем, реагирует с восстановителями, образуя азот:
3N 2 O + 2NH 3 = 4N 2 + 3H 2 O
Пример 3: Оксид алюминия сплавили с карбонатом натрия, полученное твёрдое вещество растворили в воде. Через полученный раствор пропускали сернистый газ до полного прекращения взаимодействия. Выпавший осадок отфильтровали, а к профильтрованному раствору прибавили бромную воду. Полученный раствор нейтрализовали гидроксидом натрия.
Решение:
- Оксид алюминия — амфотерный оксид, при сплавлении со щелочами или карбонатами щелочных металлов образует алюминаты:
Al 2 O 3 + Na 2 CO 3 = 2NaAlO 2 + CO 2 - Алюминат натрия при растворении в воде образует гидроксокомплекс:
NaAlO 2 + 2H 2 O = Na - Растворы гидроксокомплексов реагируют с кислотами и кислотными оксидами в растворе, образуя соли. Однако, сульфит алюминия в водном растворе не существует, поэтому будет выпадать осадок гидроксида алюминия. Обратите внимание, что в реакции получится кислая соль — гидросульфит калия:
Na + SO 2 = NaHSO 3 + Al(OH) 3 - Гидросульфит калия является восстановителем и окисляется бромной водой до гидросульфата:
NaHSO 3 + Br 2 + H 2 O = NaHSO 4 + 2HBr - Полученный раствор содержит гидросульфат калия и бромоводородную кислоту. При добавлении щелочи нужно учесть взаимодействие с ней обоих веществ:
NaHSO 4 + NaOH = Na 2 SO 4 + H 2 O
HBr + NaOH = NaBr + H 2 O
Пример 4: Сульфид цинка обработали раствором соляной кислоты, полученный газ пропустили через избыток раствора гидроксида натрия, затем добавили раствор хлорида железа (II). Полученный осадок подвергли обжигу. Полученный газ смешали с кислородом и пропустили над катализатором.
Решение:
- Сульфид цинка реагирует с соляной кислотой, при этом выделяется газ — сероводород:
ZnS + HCl = ZnCl 2 + H 2 S - Сероводород — в водном растворе реагирует со щелочами, образуя кислые и средние соли. Поскольку в задании говорится про избыток гидроксида натрия, следовательно, образуется средняя соль — сульфид натрия:
H 2 S + NaOH = Na 2 S + H 2 O - Сульфид натрия реагирует с хлоридом двухвалентного железа, образуется осадок сульфида железа (II):
Na 2 S + FeCl 2 = FeS + NaCl - Обжиг — это взаимодействие твёрдых веществ с кислородом при высокой температуре. При обжиге сульфидов выделяется сернистый газ и образуется оксид железа (III):
FeS + O 2 = Fe 2 O 3 + SO 2 - Сернистый газ реагирует с кислородом в присутствии катализатора, образуя серный ангидрид:
SO 2 + O 2 = SO 3
Пример 5: Оксид кремния прокалили с большим избытком магния. Полученную смесь веществ обработали водой. При этом выделился газ, который сожгли в кислороде. Твёрдый продукт сжигания растворили в концентрированном растворе гидроксида цезия. К полученному раствору добавили соляную кислоту.
Решение:
- При восстановлении оксида кремния магнием образуется кремний, который реагирует с избытком магния. При этом получается силицид магния:
SiO 2 + Mg = MgO + Si
Si + Mg = Mg 2 SiМожно записать при большом избытке магния суммарное уравнение реакции:
SiO 2 + Mg = MgO + Mg 2 Si - При растворении в воде полученной смеси растворяется силицид магния, образуется гидроксид магния и силан (окисд магния реагирует с водой только при кипячении):
Mg 2 Si + H 2 O = Mg(OH) 2 + SiH 4 - Силан при сгорании образует оксид кремния:
SiH 4 + O 2 = SiO 2 + H 2 O - Оксид кремния — кислотный оксид, он реагирует со щелочами, образуя силикаты:
SiO 2 + CsOH = Cs 2 SiO 3 + H 2 O - При действии на растворы силикатов кислот, более сильных, чем кремниевая, она выделяется в виде осадка:
Cs 2 SiO 3 + HCl = CsCl + H 2 SiO 3
Задания для самостоятельной работы.
- Нитрат меди прокалили, полученный твёрдый осадок растворили в серной кислоте. Через раствор пропустили сероводород, полученный чёрный осадок подвергли обжигу, а твёрдый остаток растворили при нагревании в концентрированной азотной кислоте.
- Фосфат кальция сплавили с углём и песком, затем полученное простое вещество сожгли в избытке кислорода, продукт сжигания растворили в избытке едкого натра. К полученному раствору прилили раствор хлорида бария. Полученный осадок обработали избытком фосфорной кислоты.
- Медь растворили в концентрированной азотной кислоте, полученный газ смешали с кислородом и растворили в воде. В полученном растворе растворили оксид цинка, затем к раствору прибавили большой избыток раствора гидроксида натрия.
- На сухой хлорид натрия подействовали концентрированной серной кислотой при слабом нагревании, образующийся газ пропустили в раствор гидроксида бария. К полученному раствору прилили раствор сульфата калия. Полученный осадок сплавили с углем. Полученное вещество обработали соляной кислотой.
- Навеску сульфида алюминия обработали соляной кислотой. При этом выделился газ и образовался бесцветный раствор. К полученному раствору добавили раствор аммиака, а газ пропустили через раствор нитрата свинца. Полученный при этом осадок обработали раствором пероксида водорода.
- Порошок алюминия смешали с порошком серы, смесь нагрели, полученное вещество обработали водой, при этом выделился газ и образовался осадок, к которому добавили избыток раствора гидроксида калия до полного растворения. Этот раствор выпарили и прокалили. К полученному твёрдому веществу добавили избыток раствора соляной кислоты.
- Раствор иодида калия обработали раствором хлора. Полученный осадок обработали раствором сульфита натрия. К полученному раствору прибавили сначала раствор хлорида бария, а после отделения осадка — добавили раствор нитрата серебра.
- Серо-зелёный порошок оксида хрома (III) сплавили с избытком щёлочи, полученное вещество растворили в воде, при этом получился тёмно-зелёный раствор. К полученному щелочному раствору прибавили пероксид водорода. Получился раствор желтого цвета, который при добавлении серной кислоты приобретает оранжевый цвет. При пропускании сероводорода через полученный подкисленный оранжевый раствор он мутнеет и вновь становится зелёным.
- (МИОО 2011, тренинговая работа) Алюминий растворили в концентрированном растворе гидроксида калия. Через полученный раствор пропускали углекислый газ до прекращения выделения осадка. Осадок отфильтровали и прокалили. Полученный твердый остаток сплавили с карбонатом натрия.
- (МИОО 2011, тренинговая работа) Кремний растворили в концентрированном растворе гидроксида калия. К полученному раствору добавили избыток соляной кислоты. Помутневший раствор нагрели. Выделившийся осадок отфильтровали и прокалили с карбонатом кальция. Напишите уравнения описанных реакций.






